Jenis-Jenis Perubahan Entalpi
Posted in KIMIA
Jenis-Jenis Perubahan Entalpi
Bentuk standar dari suatu unsur adalah bentuk yang paling stabil dari unsur itu pada keadaan standar ( 298 K, 1 atm ).
Jika perubahan entalpi pembentukan tidak diukur pada keadaan standar maka dinotasikan dengan DHf
Contoh :
Catatan :
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHd. Satuannya = kJ / mol.
Perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tanda.
Menurut Marquis de Laplace, “ jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsur penyusunnya = jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsur penyusunnya. “ Pernyataan ini disebut Hukum Laplace.
Contoh :
Diketahui DHf o H2O(l) = -286 kJ/mol, maka entalpi penguraian H2O(l) menjadi gas hidrogen dan gas oksigen adalah +286 kJ/mol.
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHc. Satuannya = kJ / mol.
Contoh :
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHn. Satuannya = kJ / mol.
Contoh :
DHn reaksi = -200 kJ
DHn NaOH = -200 kJ / 2 mol = -100 kJ/mol
DHn H2SO4 = -200 kJ / 1 mol = -200 kJ/mol
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHvap. Satuannya = kJ / mol.
Contoh :
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHfus. Satuannya = kJ / mol.
Contoh :
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsub. Satuannya = kJ / mol.
Contoh :
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsol. Satuannya = kJ / mol.
- Perubahan entalpi yang diukur pada suhu 25 oC dan tekanan 1 atm ( keadaan standar) disebut perubahan entalpi standar ( dinyatakan dengan tanda DHo atau DH298 ).
- Perubahan entalpi yang tidak merujuk pada kondisi pengukurannya dinyatakan dengan lambang DH saja.
- Entalpi molar = perubahan entalpi tiap mol zat ( kJ / mol ).
- Perubahan entalpi, meliputi :
- a. Perubahan Entalpi Pembentukan Standar ( DHf o ) = kalor pembentukan
Bentuk standar dari suatu unsur adalah bentuk yang paling stabil dari unsur itu pada keadaan standar ( 298 K, 1 atm ).
Jika perubahan entalpi pembentukan tidak diukur pada keadaan standar maka dinotasikan dengan DHf
Contoh :
Catatan :
- DHf unsur bebas = nol
- Dalam entalpi pembentukan, jumlah zat yang dihasilkan adalah 1 mol.
- Dibentuk dari unsur-unsurnya dalam bentuk standar.
- b. Perubahan Entalpi Penguraian Standar ( DHd o )
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHd. Satuannya = kJ / mol.
Perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tanda.
Menurut Marquis de Laplace, “ jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsur penyusunnya = jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsur penyusunnya. “ Pernyataan ini disebut Hukum Laplace.
Contoh :
Diketahui DHf o H2O(l) = -286 kJ/mol, maka entalpi penguraian H2O(l) menjadi gas hidrogen dan gas oksigen adalah +286 kJ/mol.
- c. Perubahan Entalpi Pembakaran Standar ( DHc o )
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHc. Satuannya = kJ / mol.
Contoh :
- d. Perubahan Entalpi Netralisasi Standar ( DHn o )
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHn. Satuannya = kJ / mol.
Contoh :
DHn reaksi = -200 kJ
DHn NaOH = -200 kJ / 2 mol = -100 kJ/mol
DHn H2SO4 = -200 kJ / 1 mol = -200 kJ/mol
- e. Perubahan Entalpi Penguapan Standar ( DHovap)
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHvap. Satuannya = kJ / mol.
Contoh :
- f. Perubahan Entalpi Peleburan Standar ( DHofus )
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHfus. Satuannya = kJ / mol.
Contoh :
- g. Perubahan Entalpi Sublimasi Standar ( DHosub )
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsub. Satuannya = kJ / mol.
Contoh :
- h. Perubahan Entalpi Pelarutan Standar ( DHosol )
Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan DHsol. Satuannya = kJ / mol.

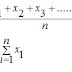


0 komentar: